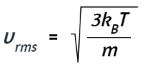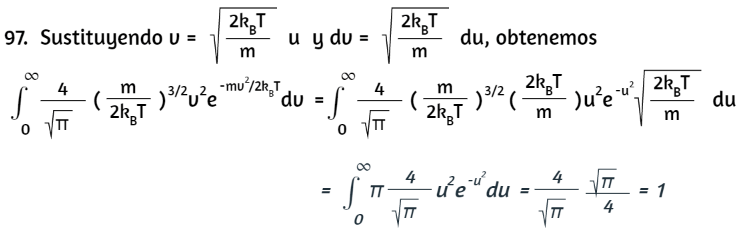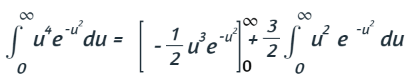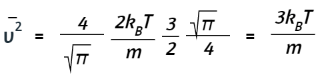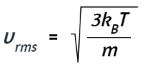Respuestas - Capítulo II
Excepto por las preguntas de los apartados de Comprueba tu aprendizaje, sólo se dan las respuestas de los numerales impares
Comprueba tu aprendizaje
2.1 Primero necesitamos calcular la masa molar (la masa de un mol) de niacina. Para hacer esto, debemos multiplicar el número de átomos de cada elemento en la molécula por la masa molar del elemento.
(6 mol de carbono)(12.0 g / mol) + (5 mol de hidrógeno (1.0 g/mol) + (1 mol de nitrógeno)(14 g/mol) + (2 mol de oxígeno)(16.0 g/mol) = 123 g/mol
Entonces tenemos que calcular la cantidad de moles en 14 mg.
(14 mg/123 g/mol)(1 g/1000 mg) = 1,14 × 10-4 mol.
Luego, usamos el número de Avogadro para calcular el número de moléculas:
N = nNA = (1,14 × 10-4 mol) (6,02 × 1023 moleculas/mol) = 6,85 × 1019 moléculas.
2.2 La densidad de un gas es igual a una constante, la masa molecular promedio, multiplicada por la densidad numérica N/V. De la ley de los gases ideales, pV = NkBT, vemos que N/V = p/kBT. Por lo tanto, a temperatura constante, en consecuencia, la densidad numérica se reducen a la mitad, la presión también debe reducirse a la mitad, y pf = 0.500 atm.
2.3 La densidad es masa por unidad de volumen, y el volumen es proporcional al tamaño de un cuerpo (como el radio de una esfera) en cubos. Entonces, si la distancia entre las moléculas aumenta en un factor de 10, entonces el volumen ocupado aumenta en un factor de 1000, y la densidad disminuye en un factor de 1000. Como suponemos que las moléculas están en contacto en líquidos y sólidos, la distancia entre los centros están en el orden de su tamaño típico, por lo que la distancia en los gases es del orden de 10 veces mayor.
2.4 Sí. Tales fluctuaciones en realidad ocurren para un cuerpo de cualquier tamaño en un gas, pero dado que el número de moléculas es inmenso para cuerpos macroscópicos, las fluctuaciones representan un pequeño porcentaje del número de colisiones, y los promedios de los que se habla en esta sección varían imperceptiblemente. En términos generales, las fluctuaciones son inversamente proporcionales a la raíz cuadrada del número de colisiones, por lo que para los cuerpos pequeños, pueden volverse significativas. Esto fue realmente observado en el siglo diecinueve para los granos de polen en el agua y se conoce como movimiento browniano.
2.5 En un líquido, las moléculas están muy juntas, colisionando constantemente entre sí. Para que un gas sea casi ideal, como el aire se encuentra en condiciones normales, las moléculas deben estar muy separadas. Por lo tanto, la trayectoria libre media es mucho más larga en el aire.
2.6 Como el número de moles es igual y sabemos que las capacidades de calor molar de los dos gases son iguales, la temperatura está a mitad de camino entre las temperaturas iniciales, 300 K.
Preguntas conceptuales
1. 2 moles, ya que contienen el doble de moléculas que el mol de oxígeno
3. presión
5. La llama contiene gas caliente (calentado por combustión). La presión sigue siendo la presión atmosférica, en equilibrio mecánico con el aire a su alrededor (o más o menos). La densidad del gas caliente es proporcional a su densidad numérica N/V (despreciando la diferencia de composición entre el gas en la llama y el aire circundante). A una temperatura más alta que el aire circundante, la ley de los gases ideales dice que N/V = p/kBT es menor que la del aire circundante. Por lo tanto, el aire caliente tiene una densidad menor que el aire circundante y se eleva por la fuerza de flotación.
7. La trayectoria libre media es inversamente proporcional al cuadrado del radio, por lo que disminuye en un factor de 4. El tiempo libre medio es proporcional al camino libre medio e inversamente proporcional a la velocidad rms, que a su vez es inversamente proporcional a la raíz cuadrada de la masa. Eso da un factor de √8 en el numerador, por lo que el tiempo libre promedio disminuye en un factor de √2.
9. Como son más masivos, su gravedad es más fuerte, por lo que la velocidad de escape de ellos es mayor. Como están más alejados del Sol, son más fríos, por lo que las velocidades de las moléculas atmosféricas, incluidos el hidrógeno y el helio, son más bajas. La combinación de esos hechos significa que relativamente pocas moléculas de hidrógeno y helio han escapado de los planetas exteriores.
11. Uno donde se almacena nitrógeno, ya que el exceso de CO2 causará una sensación de sofocación, pero el exceso de nitrógeno y el oxígeno insuficiente no lo harán.
13. Menos, porque a temperaturas más bajas su capacidad de calor era solo 3RT/2.
15. a. falso; b. cierto; c. cierto; d. verdadero
17. 1200 K
Problemas
19. a. 0.137 atm; b. pg = (1 atm) T2V1/T1V2 - 1atm. Debido a la expansión del vidrio, V2 = 0.99973. Multiplicar por ese factor no hace ninguna diferencia significativa.
21. a. 1,79 × 10-3 mol; b. 0,222 mol; c. 1.08 × 1021 moléculas para el nitrógeno, 1.37 × 1023 moléculas para el dióxido de carbono
23. 7.84 × 10-2 mol
25. 1.87 × 103
27. 2.47 × 107 moleculas
29. 6.95 × 105 Pa; 6.86 atm
31. a. 9.14 × 106 Pa; b. 8.22 × 106 Pa; c. 2,15 K; d. no
33. 40.7 km
35. a. 0.61 N; b. 0,20 Pa
37. a. 5,88 m/s; b. 5.89 m/s
39. 177 m/s
41. 4.54 × 103
43. a. 0.0352 mol; b. 5,65 × 10-21 J; c. 139 J
45. 21.1 kPa
47. 458 K
49. 3.22 × 103 K
51. a. 1.004; b. 764 K; c. Esta temperatura es equivalente a 915 ºF, que es alta pero no imposible de lograr. Por lo tanto, este proceso es factible. A esta temperatura, sin embargo, puede haber otras consideraciones que dificultan el proceso (En general, el enriquecimiento de uranio por difusión gaseosa es realmente difícil y requiere muchos pasos).
53. 65 mol
55. a. 0.76 atm; b. 0.29 atm; c. La presión allí apenas supera el nivel fatal.
57. 4.92 × 105 K; Sí, esa es una temperatura imprácticamente alta.
59. Poliatómico
61. 3.08 × 103 J
63. 29.2 °C
65. -1.6 °C
67. 0.00157
69. Aproximadamente 0.072. Las respuestas pueden variar ligeramente. Una respuesta más precisa es 0.074.
71. a. 419 m/s; b. 472 m/s; c. 513 m/s
73. 541 K
75. 2400 K para las tres partes
Problemas Adicionales
77. a. 1.20 kg/m3; b. 65.9 kg/m3
79. 7.9 m
81. a. fluido supercrítico; segundo. 3.00 × 107Pa 83. 40.18% 85. a. 2,21 × 1027moleculas / m3; segundo. 3,67 × 103 mol / m3 87. 8,2 mm 89. a. 1080 J/kg °C; b. 12%
91. 2√e/3 o aproximadamente 1.10
93. a. 411 m/s; b. Según la
Tabla 2.3
, el CV de H2S es significativamente diferente del valor teórico, por lo que el modelo de gas ideal no lo describe muy bien a temperatura y presión ambiente, y la distribución de velocidad de Maxwell-Boltzmann para gases ideales puede no ser muy buena, aún menos a una temperatura más baja.
Problemas Desafío
95. 29.5 N/m
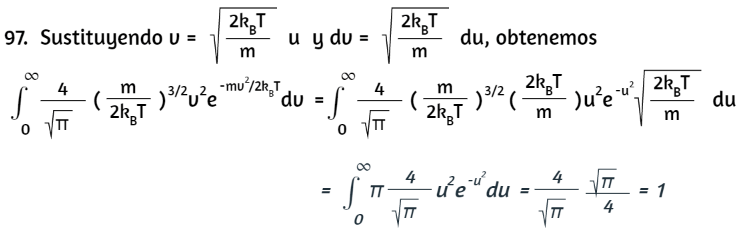

Como en el problema anterior, integramos por partes:
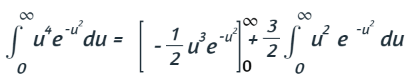
De nuevo, el primer término es 0, y se nos dio en un problema anterior que la integral en el segundo término es igual a √π/4. Ahora tenemos
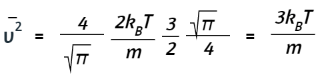
Tomar la raíz cuadrada de ambos lados da el resultado deseado: